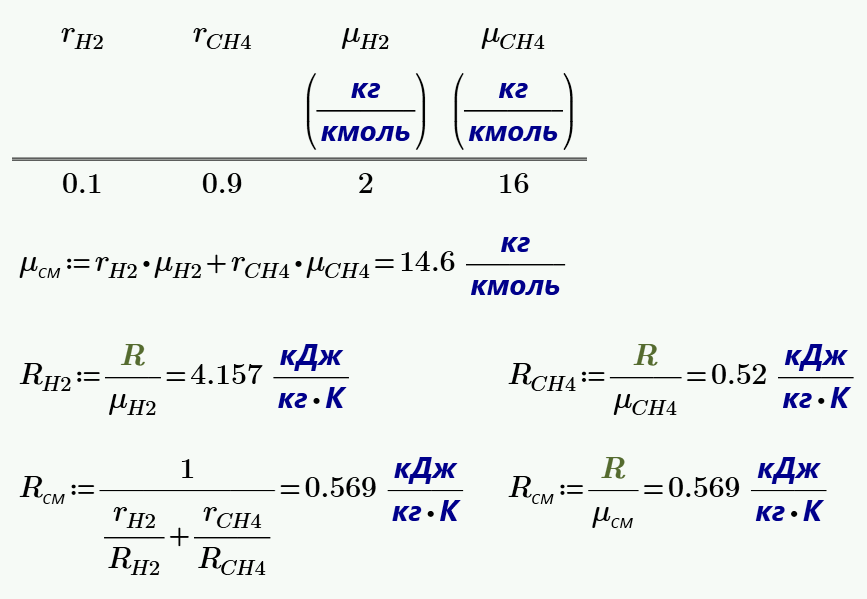
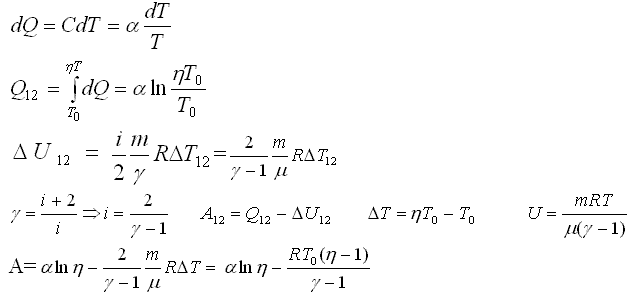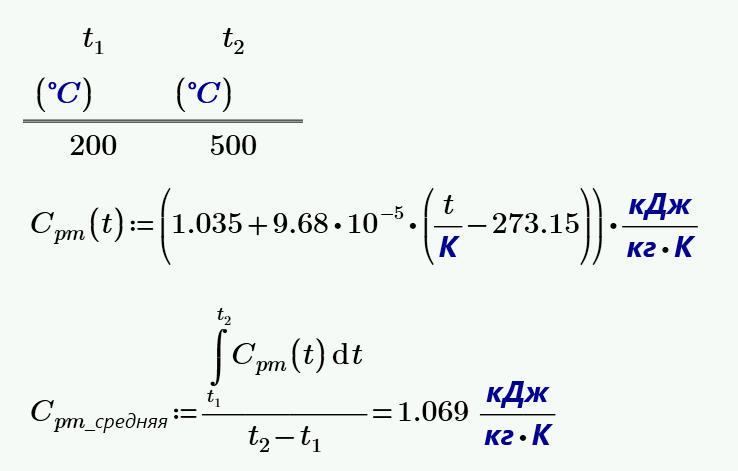Найти молярные теплоёмкости газа при постоянном давлении и постоянном объеме
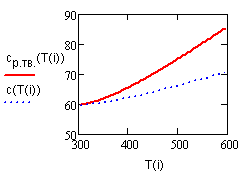
На значение молярной теплоёмкости влияет температура вещества и другие термодинамические параметры. Материал из Википедии — свободной энциклопедии. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 мая года ; проверки требуют 2 правки. Для образца переменного химического состава эквипарциальная молярная теплоёмкость также является переменной что сглаживается, как упоминалось выше, законом Дюлонга — Пти.

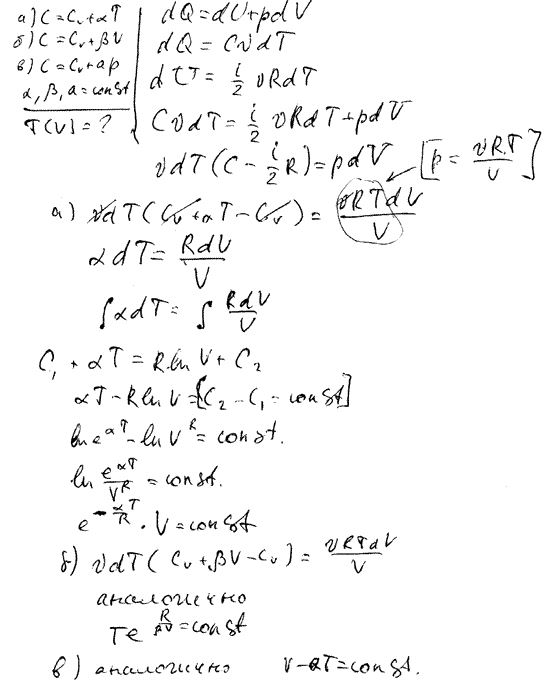
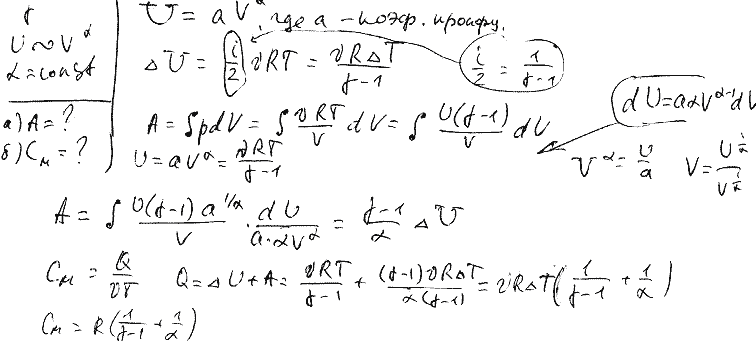
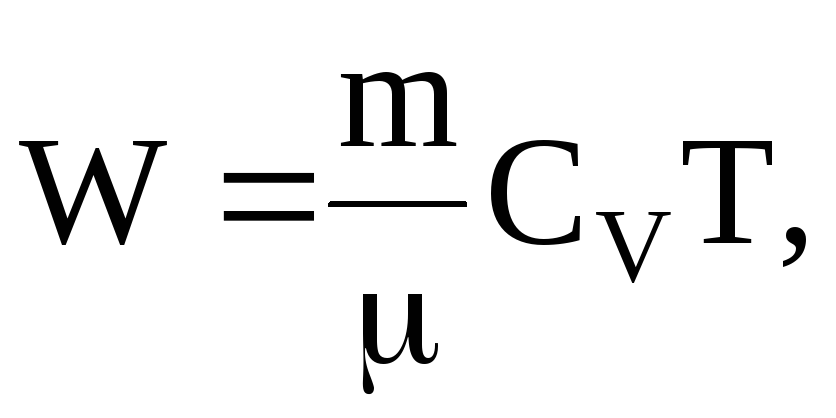
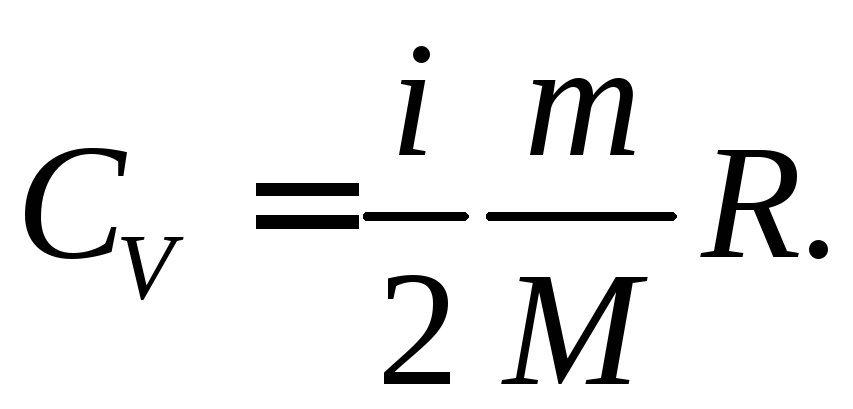

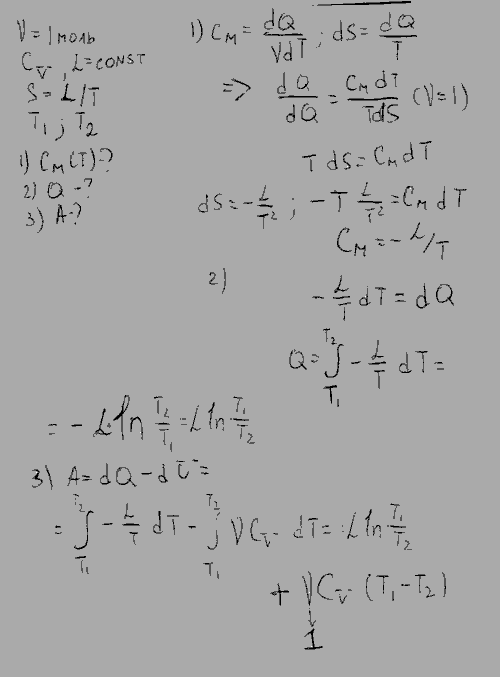




Идеальный газ - математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. Определить количество теплоты, подведенной к воздуху. Для использования теплоты газов, уходящих из топок паровых котлов, в газоходах последних устанавливают воздухоподогреватели. Принять, что вся теплота, отдаваемая газами, воспринимается воздухом и процесс происходит при неизменном давлении.
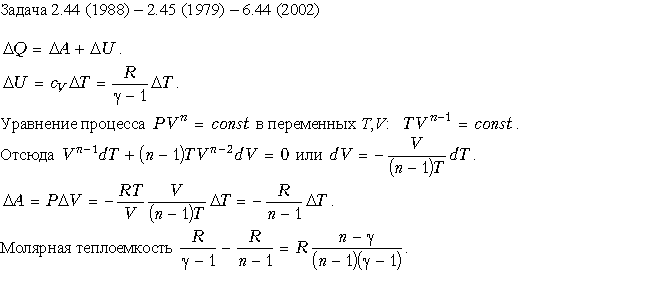




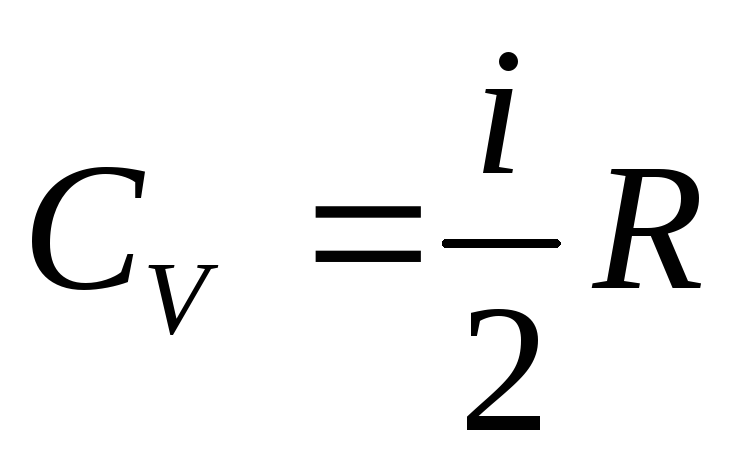



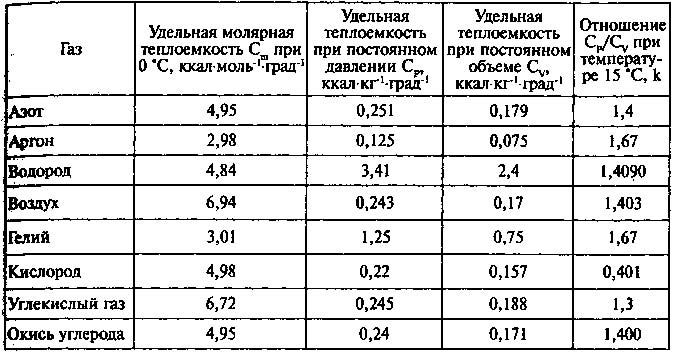
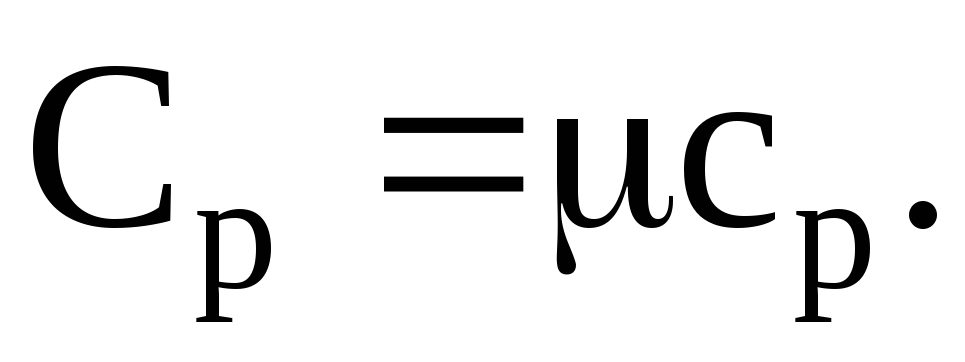
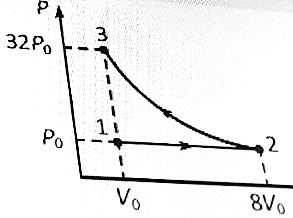
Молярная теплоемкость m кг некоторого газа равна c , при этом известна его молярная масса M. Чему равна теплоемкость газа C? Определить молярную теплоемкость при постоянном объеме идеального газа, состоящего из жестких двухатомных молекул.